Grâce aux piles, plus besoin de rester attaché à une prise. Elles nous facilitent tellement la vie en nous permettant par exemple de changer de chaîne sans bouger du canapé ! Le hic c’est que contrairement aux batteries, elles n’ont qu’une seule vie qui n’est pas bien longue ! A moins de leur en offrir une seconde grâce au recyclage. Pourquoi est-ce que les recycler est si important ? Pour le comprendre, rien de mieux que de se mettre dans la peau d’une pile. Plongeon dans toute sa composition (1ère partie)
Il était une fois des cuisses de grenouilles qui rencontrèrent des métaux… Oui tout partirait de cuisses de grenouilles. En 1789, un médecin et physicien italien Luigi Galvani observe que les muscles des cuisses de cet amphibien se contractent lorsqu’elles sont en contact avec des métaux. Et que la réaction s’amplifie s’il y a deux métaux distincts.
Dix ans plus tard, Allessandro Volta, autre physicien italien, découvre que l’on peut générer de l’électricité avec deux plaques de métal mises en contact par un liquide conducteur. Il a alors l’idée de superposer des disques de zinc et de cuivre et des rondelles de carton imbibées d’eau salée pour conduire le courant formant ainsi… une pile !
Mais c’est un français, le chimiste George Leclanché qui invente le système de la pile moderne : une tige de charbon à la place du cuivre et une pâte de chlorure d’ammonium à la place de la solution. Cette pile « sèche » devient compacte et transportable. C’est la création de la pile que nous connaissons ! On peut la définir comme un petit générateur portable d’énergie électrique qui transforme l’énergie d’une réaction chimique en énergie électrique.
La magie de la chimie.
Comment une pile peut-elle créer de l’électricité ? Entrons davantage dans sa matière… ou plutôt dans ses atomes avec l’aide de la responsable de l’unité de chimie du Palais de la découverte, Sokunthéa Thlang :
« Tout tient à un fil conducteur. Dans ce fil, des atomes, qui sont les grains de la matière. Ils sont composés de manière équilibrée d’un noyau neutre et contiennent autant de charges électriques positives, les protons, que de charges électriques négatives, les électrons. Lorsqu’une pile est en fonctionnement, des électrons se déplacent dans le fil, « poussés » d’un côté et « aspirés » de l’autre.
Pour ce faire, il faut une réaction chimique qui donne des électrons. Elle se produit généralement sur une électrode dite « anode », c’est à dire une tige de métal qui a tendance à donner des électrons. Il faut également une réaction chimique pour récupérer ces électrons. Elle se produit généralement sur une autre électrode appelée « cathode » .
Les deux électrodes sont reliées par un fil pour le passage des électrons. Et comme chacune voudra rester neutre (leurs atomes seront toujours en quête de neutralité), elles baignent dans une tierce composition (dit électrolytes) contenant des ions positifs et négatifs. Cette solution ionique est le siège de ces réactions chimiques qui mettent en jeu des électrons : dès que ces derniers (charges négatives) partent de l’anode, celle-ci peut libérer les ions positifs qui vont s’attacher aux ions négatifs de la solution. Et vice-versa avec la cathode qui aura un surplus d’électrons. Le rôle de l’électrolyte est d’assurer le passage du courant électrique dans la solution grâce à la présence des ions».
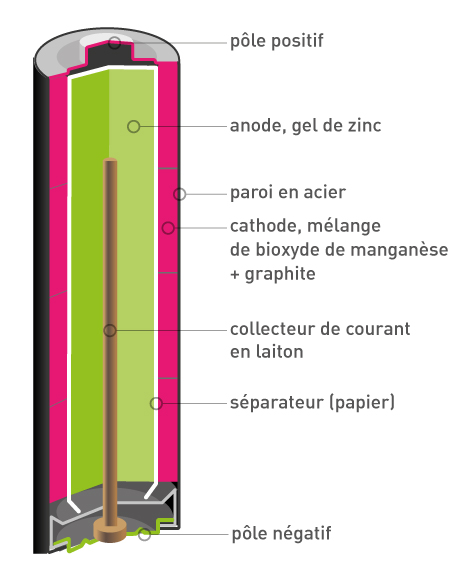
Quelle vie à l’intérieur d’une si petite pile ! Si l’on pouvait la déshabiller, on verrait tout que ce système est bien compacté : un godet (enveloppe) avec une tige de dioxyde de manganèse/carbonne (cathode), du gel de zinc (anode), du papier séparé par un gel de chlorure d’ammonium pour éviter que les deux électrodes se touchent et le tout imbibé dans une solution ionique.
A chaque pile sa recette.
Si la structure/ organisation est commune, la composition varie en fonction du type de piles. Toutes ne se ressemblent pas et contiennent des métaux et produits différents. Chacune a sa propre recette en quelque sorte. Parmi les plus utilisées, les piles salines contiennent pour leur majorité du zinc pour anode, du carbone ou du manganèse comme cathodes et un électrolyte acide (chlorure d’ammonium par exemple). N’offrant que de faibles tensions, elles servent davantage pour les petits appareils électriques comme des horloges, radios et télécommandes.
Les piles alcalines seront constituées d’acier, de zinc et de manganèse avec un électrolyte basique (soude ou de la potasse) pour une circulation plus rapide, un débit plus intense et à plus long terme. Idéales pour des appareils à faible consommation comme pour des modèles plus performants tels que des lecteurs MP3 et des jouets électroniques.
Quant aux piles Lithium-ion, comme leur nom l’indique avec ce métal comme anode et le plus souvent du manganèse. Elles offrent une tension plus élevée pour une même masse mais les coûts de fabrication sont plus importants. On les retrouve dans l’électronique mobile. Mais aussi performantes puissent-elles être, qui dit piles, dit pas de rechargement. Ces réactions chimiques finissent par s’épuiser et les piles par arrêter de fonctionner. Sauf que les métaux eux, ne disparaissent pas. Ils pourraient être recyclés à vie. A une seule condition, que la pile usagée finisse au bon endroit ! (lire la deuxième partie)





